PREPARACIÓN DE SOLUCIONES AMORTIGUADORAS
OBJETIVO
- Que el alumno aplique sus conocimientos sobre disoluciones amortiguadoras.
- Que el alumno prepare una disolución amortiguadora, compruebe su capacidad amortiguadora y la compare con otra disolución que no presente características amortiguadoras.(QuimicaInorganica,sf)
INTRODUCCION
Las soluciones amortiguadoras están generalmente constituidas por un par acido-base conjugado, y son muy conocidos y utilizados por su característica principal; que es la de mantener el pH en un rango constante, esto se debe a que el componente básico de la solución amortiguadora reacciona con el acido que es adicionado y el componente acido reacciona con la base fuerte adicionada. (2)
Para atenuar los efectos causados por los ácidos y las bases durante las reacciones también son utilizadas estas soluciones.
(Underwood ,2009)
Algunas veces es necesario preparar y guardar una solución con un pH constante. La preservación de dicha solución es aún más difícil que su preparación:
- si la solución entra en contacto con el aire, absorberá dióxido de carbono, CO2, y se volverá más ácida.
- si la solución se guarda en un recipiente de vidrio, las impurezas alcalinas "desprendidas" del vidrio pueden alterar el pH.
Las soluciones buffer o amortiguadoras son capaces de mantener su pH en valores aproximadamente constantes, aún cuando se agreguen pequeñas cantidades de ácido o base, o se diluya la solución.
Una disolución buffer o amortiguadora se caracteriza por contener simultáneamente una especie débil y su par conjugado:
- un ácido débil y la sal de su par conjugado
HA + H2O  A– + H3O+
A– + H3O+
 A– + H3O+
A– + H3O+- una base débil y la sal de su par conjugado
B + H2O  BH+ + OH–
BH+ + OH–
 BH+ + OH–
BH+ + OH–
La disolución buffer debe contener una concentración relativamente grande de cada uno de los integrantes del par conjugado, de modo que:
- la especie ácida del sistema buffer pueda reaccionar con los iones OH– que se le añadan
- la especie básica del sistema buffer pueda reaccionar con la cantidad de iones H+ que se añadan
(Quimicageneral,sf)
La presencia del par conjugado hace que la especie débil se disocie en menor proporción:
| |
HA + H2O
 A– + H3O+ A– + H3O+ |
B + H2O
 BH+ + OH– BH+ + OH– |
La presencia de la especie débil hace que el par conjugado se hidrolice menos:
| |
A– + H2O
 HA + OH– HA + OH– | BH+ + H2O  B + H3O+ B + H3O+ |
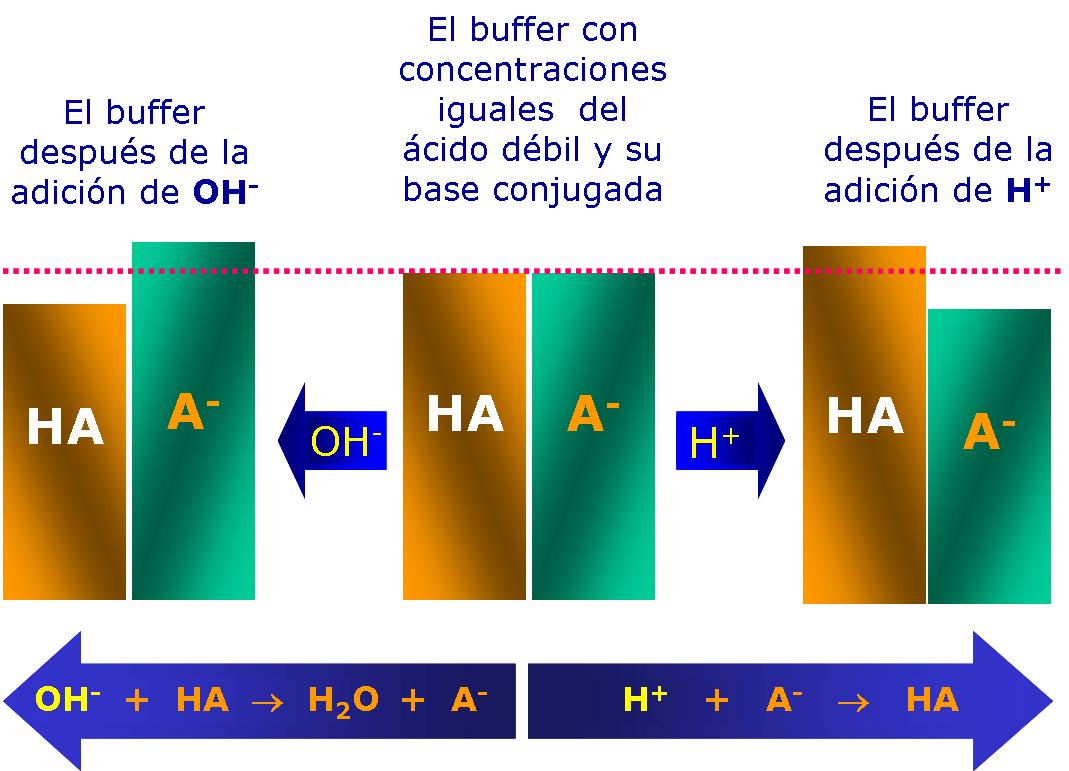 |
| Recuperado de:http://corinto.pucp.edu.pe/quimicageneral/sites/corinto.pucp.edu.pe.quimicageneral/files/images/q2unidad3/buffer.png |
COMO CALCULAR EL PH EN SOLUCIONES BUFFER
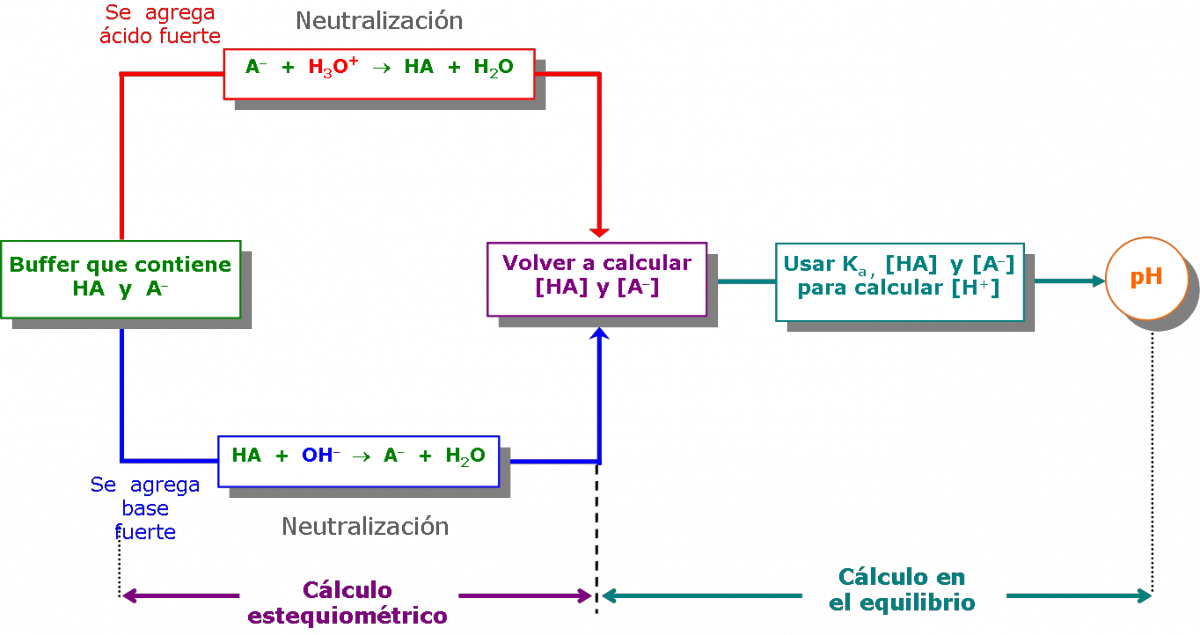 |
| Recuperado de: http://corinto.pucp.edu.pe/quimicageneral/sites/corinto.pucp.edu.pe.quimicageneral/files/images/q2unidad3/buffer-1.png |




Comentarios
Publicar un comentario